ऊष्मा Heat
ऊष्मा एक प्रकार की ऊर्जा है, जिसे कार्य में बदला जा सकता है। इसका सबसे पहले उदाहरण रमफोर्ड ने दिया, बाद में डेवी ने दो बर्फ के टुकड़ों को आपस में घिसकर पिघला दिया। चूंकि बर्फ को पिघलने के लिये ऊष्मा का और कोई स्रोत न था, अत: यह माना गया कि बर्फ को घिसने में किया गया कार्य बफ पिघलने के लिये ही गई आवश्यक ऊष्मा में बदल गया। बाद में जूल ने अपने प्रयोग से इस बात की पुष्टि की कि- ऊष्मा ऊर्जा का ही एक रूप है।
ताप
किसी पिण्ड का ताप उस पिण्ड की ऊष्मीय ऊर्जा संबंधी वह भौतिक अवस्था है, जिससे यह सूचित होता है कि किसी दूसरे पिण्ड के संपर्क में आने पर ऊष्मा का प्रवाह उस पिण्ड से दूसरे पिण्ड की ओर होगा या दूसरे पिण्ड से उस पिण्ड की ओर होगा।
ऊष्मा का मात्रक
ऊष्मा के विभिन्न मात्रक निम्न हैं-
- कैलोरी: एक ग्राम जल का ताप 1°C बढ़ाने के लिये आवश्यक ऊष्मा की मात्रा को कैलोरी कहते हैं।
- अन्तर्राष्ट्रीय कैलोरी: एक ग्राम पानी का ताप 14.5°C से 15.5°C तक बढ़ाने के लिये आवश्यक ऊष्मा की मात्रा को अन्तर्राष्ट्रीय कैलोरी कहते हैं।
- ब्रिटिश थर्मल यूनिट: 1 पौंड पानी का ताप डिग्री फारनेहाइट बढ़ाने के लिये आवश्यक ऊष्मा की मात्रा को ब्रिटिश थर्मल यूनिट कहते हैं।
1 ब्रिटिश थर्मल यूनिट = 252 कैलोरी
1 कैलोरी = 4.18 जूल
1 किलो कैलोरी = 4.18 × 103 जूल
तापमापी
तापक्रम मापने के यंत्र: साधारणतया तापमापी सिद्धान्त यह है कि ताप के बढ़ने पर इनमें डाले गये द्रवों में फैलाव होता है। मुख्य रूप से एल्कोहल व पारा ही ऐसे द्रव हैं, जो थर्मामीटर में प्रयोग किये जाते हैं। एल्कोहल का प्रयोग उन तापमापियों में किया जाता है, जो 40°C से नीचे ताप मापने के काम आते हैं। विभिन्न परिसरों का ताप मापने के लिये निम्न तापमापी प्रयोग में लाये जाते हैं –
- द्रव-तापमापी: द्रव तापमापी का उदाहरण पारा है। साधारणतः पारे का तापमापी 357°C तक के ताप का मापन कर सकता है।
- गैस तापमापी: गैस तापमापी में हाईड्रोजन गैस का उपयोग किया जाता है। हाइड्रोजन तापमापी 500°C तक के ताप को माप सकता है। 500°C से 1500°C तक के ताप को मापने में नाइट्रोजन गैस का प्रयोग किया जाता है।
- प्लेटिनम प्रतिरोध तापमापी: इससे -200°C से 1200°C तक के तापमान को मापा जाता है।
- पूर्ण विकास उत्तापमापी: इससे अत्यधिक ऊंचे तापों की माप की जाती है। यह तापमापी स्टीफन के नियम पर आधारित है, जिसके अनुसार, उच्च ताप पर किसी वस्तु से उत्सर्जित विकिरण की मात्रा इसके परमताप के चुतर्थ घात के अनुसमानुपाती है। इस तापमापी से करीब 800°C से नीचे का ताप नहीं मापते क्योंकि इससे कम ताप पर वस्तुएं ऊष्मीय विकिरण का उत्सर्जन नहीं करती। इस तापमापी से दूर की वस्तुओं, जैसे-सूर्य आदि का ताप मापा जाता है।
| विभिन्न तापमापियों का तुलनात्मक अध्ययन | |||
| सेंटीग्रेड (°Ꮯ ) | फारनेहाइट (°F) | रयूमर (°R) | केल्विन (°Ꮶ ) |
| 0 | 32 | 0 | 273 |
| 10 | 50 | 8 | 283 |
| 20 | 68 | 16 | 293 |
| 30 | 86 | 24 | 303 |
| 37 | 98.6 | 29.6 | 310 |
| (मानव शरीर का सामान्य तापक्रम) | |||
| 40 | 104 | 32 | 313 |
| 50 | 122 | 40 | 323 |
| 100 | 212 | 80 | 373 |
ताप के पैमाने
- सेल्सियस पैमाना: इस पैमाने का आविष्कार स्वीडन के वैज्ञानिक सेल्सियस ने किया था, जिसके कारण उन्हीं के नाम पर इसे सेल्सियस पैमाना कहते हैं। इस पैमाने में हिमांक को 0°C व भाप-बिंदु को 100°C में अंकित किया जाता है तथा इनके बीच की दूरी को 100 बराबर भागों में बाँट दिया जाता है। प्रत्येक भाग को 1°C कहते हैं। इस पैमाने का उपयोग अधिकतर वैज्ञानिक कारणों के लिये किया जाता है।
- फॉरेनहाइट पैमाना: इस पैमाने का आविष्कार जर्मन वैज्ञानिक फॉरेनहाइट ने किया था। इस पैमाने में ताप को अंग्रेजी के बड़े अक्षर F से प्रदर्शित करते हैं। इस पैमाने में हिमांक या निचले बिन्दु को 32°C तथा भाप बिन्दु की दूरी को 180 बराबर खानों में बाँट दिया जाता है। एक खाने का मान 1°C होता है। कुछ समय पहले तक इस पैमाने का उपयोग वैज्ञानिक मौसम का अनुमान लगाने व चिकित्सा के क्षेत्र में करते थे। अब इसके स्थान पर सेल्सियस पैमाने का उपयोग किया जाता है।
सेल्सियस पैमाने व फॉरेनहाइट पैमाने पर मापे गये ताप में निम्न सम्बन्ध है –
[latex]\frac { C }{ 100 } =\frac { F-32 }{ 180 }[/latex]
- रयूमर पैमाना: इस पैमाने पर अधोबिन्दु या हिमांक को 0°C तथा उर्ध्वबिन्दु या भाप बिन्दु को 80°C पर अंकित किया जाता है। इन दोनों बिन्दुओं के बीच की दूरी को 80°C बराबर भागों में बाँट दिया जाता है। इस पैमाने पर ताप को R से प्रदर्शित करते हैं।
सेल्सियस पैमाने, फॉरेनहाइट पैमाने तथा रयूमर पैमाने पर ताप में निम्न सम्बन्ध है –
[latex]\frac { C }{ 100 } =\frac { F-32 }{ 180 } =\frac { R }{ 80 }[/latex]
- केल्विन पैमाना: इस पैमाने पर हिमांक या अधोबिन्दु को 273°K तथा भाप बिन्दु को 373°K पर अंकित किया जाता है। इन दोनों बिन्दुओं के बीच की दूरी को समान 100 भागों में विभाजित कर दिया जाता है। इस पैमाने पर ताप को केल्विन से व्यक्त किया जाता है। इस पैमाने में अधोबिन्दु 0°K जल के हिमांक से 273°K नीचे होता है। केल्विन पैमाने 0°K को परम शून्य कहते हैं तथा सिद्धान्तत: यह माना जाता है कि 0°K न्यूनतम ताप है। इसके नीचे कोई ताप सम्भव नहीं है। सेल्सियस पैमाने के किसी मान को केल्विन पैमाने पर प्राप्त कने के लिये उसमें 273 जोड़ देते हैं तथा केल्विन पैमाने का कोई मान सेल्सियस पैमाने पर प्राप्त करने के लिये
उसमें से 273 घटा देते हैं।
[latex]K=\quad ℃\quad +\quad 273[/latex]
उष्मीय प्रसार
सामान्यतः पदार्थ को ऊष्मा देने पर पदार्थ का आयतन बढ़ता है, क्योंकि ताप बढ़ने पर पदार्थ के अणुओं के बीच की दूरी बढ़ जाती है। लेकिन कुछ पदार्थ, जैसे पानी 0°C से 4°C के बीच, सिल्वर आयोडाइड 80°C से 140°C के बीच तथा सिलिका -80°C के नीचे आदि का ताप बढ़ाने पर इनका संकुचन होता है। जब हम पदार्थ को ठण्डा करते हैं तो ठीक विपरीत क्रिया होती है, अर्थात् पदार्थ के अणुओं के बीच की दूरी घटती है व उनका संकुचन होता है।
- रेखीय प्रसार गुणांक – किसी वस्तु का रेखीय प्रसार गुणांक उसकी लम्बाई में वह प्रसार है, जो उस वस्तु की 1 सेमी. लम्बी छड़ में 1°C ताप बढ़ाने पर होता है। इसका मात्रक प्रति डिग्री सेल्सियस होता है। अर्थात्
रेखीय प्रसार गुणांक = लम्बाई में वृद्धि / प्रारंभिक लम्बाई x ताप वृद्धि
या [latex] Y=\quad \frac { V }{ V\times O }[/latex]
- क्षेत्रीय प्रसार गुणांक – किसी वस्तु की क्षेत्रीय प्रसार-गुणांक उसके क्षेत्रफल में वह प्रसार है, जो वस्तु के एकांक क्षेत्रफल का ताप 1°C बढ़ाने पर होता है। अर्थात्
क्षेत्रीय प्रसार गुणांक = क्षेत्रफल में वृद्धि / प्रारंभिक क्षेत्रफल × ताप वृद्धि
या [latex]B=\quad \frac { A }{ A\times O }[/latex]
- आयतन प्रसार गुणांक – किसी वस्तु का आयतन प्रसार-गुणांक उस वस्तु के आयतन में वह प्रसार है, जो वस्तु के एकांक आयतन का ताप 1°C बढ़ाने पर होता है। अर्थात्
आयतन प्रसार गुणांक = आयतन में वृद्धि / प्रारंभिक आयतन × ताप वृद्धि
या [latex]Y=\frac { V }{ V\times O }[/latex]
आयतन, क्षेत्रीय और रेखीय प्रसार गुणांक में सम्बन्ध
[latex]a=\frac { B }{ 2 } =\frac { Y }{ 3 }[/latex]
- नियत आयतन पर विशिष्ट ऊष्मा: इस दशा में 1 ग्राम गैस का ताप 1°C बढ़ाने के लिए जितनी ऊष्मा की आवश्यकता होती है, वह नियत आयतन पर गैस की विशिष्ट ऊष्मा कहलाती है, यह Cv से प्रदर्शित की जाती है।
- नियम दाब पर विशिष्ट ऊष्मा: नियत दाब पर किसी गैस की विशिष्ट ऊष्मा, ऊष्मा की वह मात्रा है, जो 1 ग्राम गैस का ताप, नियत दाब पर 1°C बढ़ाने के लिए आवश्यक है। यह Cp से प्रदर्शित की जाती है। Cv तथा Cp के मात्रक कैलोरी/ग्राम °C है।
ग्राम-अणुक विशिष्ट ऊष्मायें
यदि Cv व Cp गैस की स्थिर आयतन व स्थिर दाब पर ग्राम-अणुक ऊष्मायें हों तो
Cv=MCv तथा Cp= MCp
जहाँ M गैस का अणु भार है।
Cv व Cp का मात्रक कैलोरी/मोल-°C है। इन्हें जूल/मोल-°C में भी व्यक्त कर सकते हैं।
Cp– Cv = R (मेयर का सूत्र)
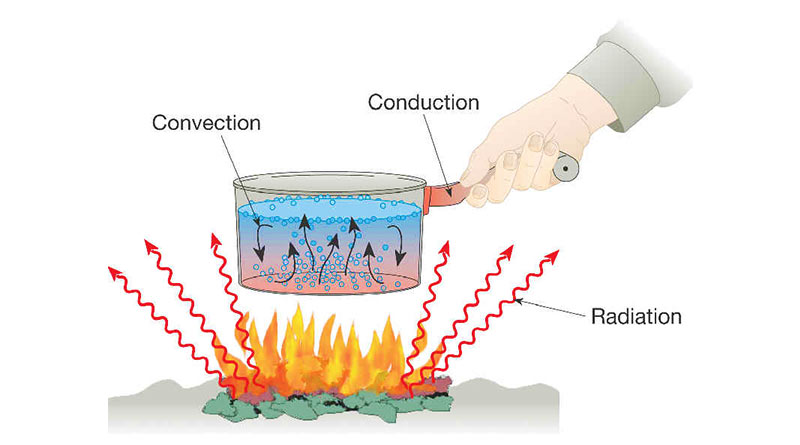
ऊष्मा का संचरण
पदार्थ में तापान्तर के कारण ऊष्मा का एक स्थान से दूसरे स्थान तक स्थानान्तरण होता है। जिस प्रकार कोई द्रव सदैव ऊचे तल से नीचे तल की ओर बहता है, ठीक उसी प्रकार से ऊष्मा भी ऊंचे ताप की वस्तु से नीचे ताप की वस्तु की ओर जाती है। ऊष्मा के इस स्थानान्तरण को ही ऊष्मा का संचरण कहते हैं। साधारणतया एक स्थान से दूसरे स्थान तक ऊष्मा का संचरण निम्न तीन विधियों से होता है –
(1) चालन, (2) संवहन तथा (3) विकिरण।
- चालन: चालन के द्वारा ऊष्मा पदार्थ के एक स्थान से दूसरे स्थान तक, पदार्थ के कणों को अपने स्थान का परित्याग किये बिना पहुंचती है। जब किसी धातु की छड़ के एक सिरे को गर्म किया जाता है तो शीघ्र ही दूसरा सिरा भी गर्म हो जाता है। ऊष्मा का यह संचरण पदार्थ के अणुओं के द्वारा होता है। जब छड़ के सिरे को गर्म किया जाता है तो इस सिरे पर स्थित अणुओं में कम्पन बढ़ जाने से उनकी ऊष्मीय ऊर्जा बढ़ जाती है। कम्पन करने वाले ये अणु अपने से आगे वाले अणुओं पर लगातार टकराते हैं तथा अपनी बढ़ी हुई ऊर्जा उन्हें स्थानान्तरित करते जाते हैं। इस प्रकार ऊष्मा का संचार एक दूसरे से दूसरे सिरे की ओर होता रहता है। ठोस में ऊष्मा का संचरण इसी विधि से होता है। पदार्थ में चालन द्वारा ऊष्मा पर संचरण ऊष्मा चालकता कहलाती है। ऊष्मा चालकता पदार्थ की प्रवृत्ति पर निर्भर करती है तथा जिन पदार्थों में ऊष्मा का चालन जितना अधिक होता है, उनकी ऊष्मा चालकता भी उतनी ही अधिक होती है। ऊष्मा चालकता के आधार पर हम पदार्थों का वर्गीकरण तीन प्रकार से कर सकते हैं –
(i) चालक: जिन पदार्थों से होकर ऊष्मा का चालन सरलता से हो जाता है, उन्हें चालक कहते हैं। ऐसे पदार्थों की ऊष्मा चालकता अधिक होती है। सभी धातु, अम्लीय जल, मानव शरीर आदि ऊष्मा के अच्छे चालक हैं।
(ii) कुचालक: जिन पदार्थों में ऊष्मा का चालन सरलता से नहीं होता या बहुत कम होता है, उन्हें कुचालक कहते हैं। लकड़ी, काँच, सिलिका, वायु, गैसें तथा रबर आदि ऊष्मा के कुचालक पदार्थ हैं।
(iii) ऊष्मारोधी: जिन पदार्थों में ऊष्मा का चालन बिल्कुल नहीं होता, उन्हें ऊष्मारोधी पदार्थ कहते हैं। ऐसे पदार्थों की ऊष्मा चालकता शून्य होती है। ऐस्बेस्टस व एवोनाइट ऊष्मारोधी पदार्थ हैं।
- संवहन: इस विधि में ऊष्मा का चालन पदार्थ के कणों के स्थानान्तरण से धारायें बहती हैं जिन्हें संवहन धारायें कहते हैं। गैसों व द्रवों में ऊष्मा का संचरण संवहन द्वारा ही होता है। ठोसों के कण चूंकि अपना स्थान नहीं छोड़ते, अत: उन्हें इस विधि से गर्म नहीं किया जा सकता। वायु तथा द्रवों में संवहन धारायें ऊपर की ओर चलती हैं। जल बर्तन में किसी द्रव में गर्म किया जाता है तो तली का द्रव गर्म होने के कारण हल्का होकर ऊपर उठता है और इस प्रकार संवहन धारायें बनती हैं। यदि हम द्रव को बर्तन की तली से गर्म न करके द्रव की ऊपरी स्वतत्र जल को गर्म करें तो संवहन धारायें नहीं बनेगीं, क्योंकि इस अवस्था में द्रव हल्का होकर ऊपर ही तैरता रहेगा।
- विकिरण: चालन व संवहन के द्वारा ऊष्मा संचरण के लिये किसी न किसी माध्यम की आवश्यकता पड़ती है। विकिरण में ऊष्मा संचरण के लिये किसी माध्यम की आवश्यकता नहीं होती तथा इसके द्वारा ऊष्मा का संचरण निर्वात् में भी होता है। सूर्य से हम तक ऊष्मा विकिरण के द्वारा ही आती है।
उत्सर्जन
प्रत्येक वस्तुयें सभी ताप पर विकिरण द्वारा ऊर्जा का उत्सर्जन करती हैं। इस ऊर्जा को विकिरण ऊर्जा या ऊष्मीय विकिरण कहते हैं। यह ऊर्जा विद्युत चुम्बकीय तरंगों के रूप में प्रकाश की चाल से चलती है। वस्तुओं का ताप बढ़ाने पर उनसे निकलने वाली विकिरण ऊर्जा बढ़ती जाती है तथा उत्सर्जन वस्तु के तल की प्रकृति, क्षेत्रफल, ताप आदि पर निर्भर करती है। यदि वस्तु का ताप, उसके चारों ओर के माध्यम के ताप से ऊंचा होता है, तो उस वस्तु के पृष्ठ से तापान्तर के कारण चारों ओर के माध्यम से विकिरण ऊर्जा का उत्सर्जन होता है। किसी ऊष्मा स्रोत की उत्सर्जक क्षमता किसी ताप पर उसके प्रति एकांक तल से प्रति एकांक समय में उत्सर्जित विकिरण ऊर्जा से मापी जाती है। प्राय: यह पाया जाता है कि चमकदार व श्वेत तल से ऊष्मीय विकिरण का अवशोषण बहुत कम होता है अर्थात् इन तलों की अवशोषण क्षमता कम होती है; दूसरी ओर काले व खुरदरे तलों से ऊष्मीय विकिरण का अवशोषण अधिक होता है जो पिण्ड अपने सतह से सभी प्रकार के ऊष्मीय विकिरण का पूर्णतया अवशोषण करता है, उसे कृष्ण पिण्ड कहते हैं।
अवशोषण
जब ऊष्मीय विकिरण किसी पृष्ठ पर गिरता है, तो उसका कुछ भाग परावर्तित हो जाता है और कुछ भाग पृष्ठ से संचरित होकर निकल जाता है तथा शेष भाग पृष्ठ द्वारा अवशोषित कर लिया जाता है। इस अवशोषित विकिरण द्वारा पृष्ठ का ताप बढ़ जाता है। पिण्ड द्वारा इस प्रकार ऊष्मीय विकिरण के अवशोषित होने की क्रिया को अवशोषण तथा इस प्रकार के पिण्ड को अवशोषक पिण्ड कहते हैं। चूंकि विकिरण का कुछ भाग पिण्ड द्वारा परावर्तित कर दिया जाता है, अत: हम ऊष्मीय विकिरण के आधार पर पिण्डों को दो श्रेणियों में बाँट देते हैं। सफेद व चमकीले तल अच्छे परावर्तक व बुरे अवशोषक होते हैं। अर्थात् यदि उन पर ऊष्मीय विकिरण आपतित हो तो वे इसका अधिकतर भाग परावर्तित कर देते हैं। दूसरी ओर वे पिण्ड जो अपने ऊपर आपतित विकिरण का अधिकतर भाग अवशोषित कर लेते हैं, अच्छे अवशोषक तथा बुरे परावर्तक कहलाते हैं। काली व खुरदरी सतहें, विकिरण के अच्छे अवशोषक व बुरे उत्सर्जक कहलाते हैं।
आार्द्रता
वायुमण्डल में मौजूद अदृश्य जलवाष्प की मात्रा को आर्द्रता कहते हैं। वायुमण्डल में जलवाष्प की मात्रा स्थान और समय के अनुसार बड़ी ही परिवर्तनशील होती है। कई कारणों से यह बड़े ही महत्व की होती है। इनमें से प्रमुख कारण निम्नलिखित हैं –
- वायुमण्डलीय हवा के किसी खास आयतन में मौजूद जलवाष्प की मात्रा वृष्टि के लिए वायुमण्डल की संभावित क्षमता का संकेत देती है।
- जलवाष्प विकिरण का शोषण करता है, इसलिए यह पृथ्वी द्वारा ऊष्मा विकिरण का एक सक्रिय नियंत्रक है।
- हवा में मौजूद जलवाष्प की मात्रा तूफान के विकास के लिए वायुमण्डल में संचयित गुप्त ऊर्जा की मात्रा पर निर्भर करती है। वायुमण्डल हवा में मौजूद जलवाष्प की मात्रा मानव शरीर के ठण्डे होने की दर को प्रभावित करती है।
निरपेक्ष आर्द्रता
हवा के प्रति इकाई आयतन में विद्यमान जलवाष्प की मात्रा को निरपेक्ष आर्द्रता कहते हैं। इसे अधिकतर ग्राम प्रति घनमीटर में व्यक्त किया जाता है। वायुमण्डल की जलवाष्प धारण करने की क्षमता पूर्णत: तापमान पर निर्भर करती है। हवा की आर्द्रता स्थान-स्थान पर और समय-समय पर बदलती रहती है। तापमान में वृद्धि हवा की जलधारण क्षमता को बढ़ाती है, जबकि तापमान में गिरावट उसकी इस क्षमता को घटाती है। फिर भी यह एक विश्वनीय सूचकांक नहीं है, क्योंकि तापमान और वायुदाब में परिवर्तन के साथ ही हवा के आयतन में भी परिवर्तन होता रहता है और इस प्रकार निरपेक्ष आर्द्रता भी बदल जाती है।
सापेक्ष आर्द्रता
किसी दिये हुये ताप पर, वायु के किसी आयतन में उपस्थिति जलवाष्प की मात्रा तथा उसी ताप पर उसी आयतन की वायु को संतृप्त करने के लिए आवश्यक जलवाष्प की मात्रा के अनुपात को आपेक्षिक आर्द्रता कहते हैं। इसे प्रतिशत में व्यक्त करते हैं। आपेक्षिक आर्द्रता को मापने के लिए हाइग्रोमीटर नामक यंत्र का प्रयोग करते हैं। ताप बढ़ने पर आपेक्षिक आर्द्रता बढ़ जाती है। यही कारण है कि गर्मी के दिनों में सर्दियों की अपेक्षा वायु को संतृप्त करने के लिये अधिक जलवाष्प की आवश्यकता होती है, जिससे गर्मियों में अधिक वाष्पन होता है। गर्मियों के दिनों में कपड़ों आदि का जल्दी सूखना इसी कारण सम्भव होता है।
प्रेशर कुकर
सामान्य वायुमण्डलीय दाब पर जल 100°C पर उबलता है। लेकिन, जब दाब को बढ़ाया जाता है तो जल का क्वथनांक बढ़ जाता है। प्रेशर कुकर में दाब में वृद्धि होने के कारण जल 100°C से अधिक तापमान पर उबलता है। अत: प्रेशर कुकर के अन्दर पकाए जाने वाली वस्तु को अधिक तापमान मिलता है और खाना जल्द पक जाता है। अधिक ऊंचाई वाले स्थानों पर वायुमण्डलीय दाब निम्न होता है, जिससे जल का क्वथनांक कम हो जाता है तथा खाना पकाने में अधिक समय लगता है। अत: ऐसे स्थानों पर प्रेशर कुकर में खाना पकाना समान होता है।
वाष्पीकरण
जल के तरल से गैसीय अवस्था में परिवर्तन की प्रक्रिया को वाष्पीकरण कहते हैं। वाष्पीकरण की दर कई कारकों पर निर्भर करती है – (i) तापमान, (ii) हवा में मौजूद जलवाष्प की मात्रा या हवा की आर्द्रता तथा (iii) हवा की गति। यदि हवा में मौजूद जलवाष्प की मात्रा कम है तो हवा की अवशोषण-क्षमता और धारक क्षमता अधिक होती है। इसके विपरीत अधिक आर्द्र हवा की अवशोषण क्षमता और धारक क्षमता कम होती है। इसी प्रकार हवा का तापमान बढ़ने से उसकी उपरोक्त क्षमताएं बढ़ती हैं। हवा में गति के कारण जल के ऊपर टिकी हवा का संतृप्त भाग हट जाता है और असंतृप्त भाग पहुँच जाता है, जिसमें अवशोषण क्षमता अधिक होती है। अत: हवा की गति जितनी ही तेज होगी, वाष्पीकरण की मात्रा उतनी ही अधिक होगी।
संघनन
जल के गैसीय अवस्था में तरल या ठोस अवस्था में बदलने की प्रक्रिया को संघनन कहते हैं। जब आर्द्र हवा ठण्डी होने लगती है तो वह एक ऐसी स्थिति में पहुंच सकती है, जहां उसमें मौजूद जलवाष्प की मात्रा उसकी धारक क्षमता से अधिक हो। उस स्थिति में, तापमान के अनुसार, यह अतिरिक्त जलवाष्प संघनित होकर तरल या ठोस अवस्था में बदल जाता है। खुली स्वच्छंद हवा में अति सूक्ष्म कणों के इर्द-गिर्द की हवा के ठण्डी होने से भी संघनन की प्रक्रिया होती है। इस प्रकार के सूक्ष्म कणों को संघनन केंद्र कहते हैं। धूल के कण, धुएं की कालिख और समुद्री नमक के कण, विशेष तौर पर अच्छे संघनन केंद्र होते हैं क्योंकि वे जल का अवशोषण करते हैं। इन कणों को आर्द्रताग्राही कण कहते हैं। संघनन की प्रक्रिया दो कारकों पर निर्भर करती है – (i) तापमान में कमी और (ii) हवा की सापेक्ष आर्द्रता। संघनन की प्रक्रिया कई बदलती परिस्थितियों में होती है, जो नीचे दी गई परिवर्ती घटकों में किसी न किसी प्रकार जुड़ी रहती है। ये परिवर्ती घटक हैं हवा का आयतन, तापमान, वायुदाब और आर्द्रता।
इस प्रकार संघनन निम्नलिखित परिस्थितियों में हो सकती है-
- जब हवा का तापमान घटकर ओसांक तक पहुंच जाए परन्तु उसका आयतन स्थिर रहे,
- जब हवा का आयतन, ऊष्मा की मात्रा बढ़ाए बिना ही बढ़ जाए,
- जब हवा की आर्द्रता धारण-क्षमता, तापमान और आयतन के संयुक्त रूप से घटने के कारण घटकर हवा में विद्यमान आर्द्रता की मात्रा से कम हो जाए, अथवा
- जब वाष्पीकरण द्वारा हवा में आर्द्रता के अतिरिक्त मात्रा मिला दी जाए।
- हिमांक को ऊपर ओस, पाला, कुहरा तथा कुहासा पहली दशा में बनते हैं और विभिन्न प्रकार के बादलों का निर्माण दूसरी दशा में होता है।
थर्मस फ्लास्क
वस्तुओं को देर तक ठण्डा व गर्म रखने के लिए एक विशेष प्रकार की बोतल का प्रयोग किया जाता है, जिसे थर्मस फ्लास्क कहते हैं। इस बोतल की दीवारें शीशे की दो परतों से बनी होती हैं तथा दोनों दीवारों के बीच की हवा निकाल कर वहीं निर्वात् उत्पन्न कर दिया जाता है। बोतल को एक टीन के डिब्बे में कार्क के टुकड़ों के ऊपर रखकर चारों ओर छोटे-छोटे काक के टुकड़े लगा दिये जाते हैं। अब इस बोतल में किसी गर्म या ठण्डी वस्तु को रखा जाता है तो उस पर बाहरी किसी प्रवाह का असर नहीं होता अर्थात् चालन, संवहन, विकिरण, वाष्पीकरण आदि सभी प्रकार से ऊष्मा का आना-जाना रुक जाता है तथा बोतल के अन्दर का ताप 30 घण्टे तक के लिये स्थिर हो जाता है। इस बोतल का आविष्कार डिवार (James Dewar) ने किया था, इसीलिये इसे डिवार फ्लास्क के नाम से भी जाना जाता है।
ग्रीनहाउस
कुछ विकिरण जिनकी तरंगदैर्ध्य छोटी होती हैं, जैसे- प्रकाश, वे कांच से पार हो जाते हैं, अर्थात् कांच उनके लिये पारदर्शी माध्यम का कार्य करता है, जबकि कुछ विकिरणों जैसे-ऊष्मा आदि के लिए यह अवरोधक का कार्य करता है। बागवानी में पौधों में ऊष्मा संचित करने के लिए कांच के छोटे-छोटे घर बनाये जाते हैं। सूर्य का प्रकाश इन घरों में प्रवेश कर जाता है व उसमें उत्पन्न ऊष्मा, इन घरों से वापस वातावरण में नहीं आ पाती, क्योंकि कांच इसके लिये अचालक की भांति व्यवहार करता है। अत: ऊष्मा अन्दर ही रह कर पौधों को गर्म रखती है। इसी को ग्रीन हाउस प्रभाव कहते हैं।
कार्बन हाई आंक्साइड, मिथेन, क्लोरोफ्लोरो कार्बन, जलवाष्प, नाइट्रस ऑक्साइड आदि ऊष्मारोधी गैसें पृथ्वी के चारों ओर आच्छादित होकर ऊष्मारोधी घेरा बनाती हैं, जिससे पृथ्वी पर सौर विकिरण आ तो जाते हैं लेकिन ये गैसें इसके द्वारा उत्पन्न ऊष्मा को वापस अंतरिक्ष में नहीं जाने देती, जिससे वायुमण्डल के ताप में निरंतर वृद्धि हो रही है। यदि इन गैसों के आच्छादित होने की गति यही रही तो अगले पचास वर्षों में पृथ्वी के तापमान में 4 से 5 डिग्री सेण्टीग्रेड तक वृद्धि होने की सम्भावना है। एक अनुमान के अनुसार यदि 3.5°C की वृद्धि हो जाये तो ध्रुवों की बर्फ पिघलने लगेगी, जिसके फलस्वरूप समुद्र के जल स्तर में वृद्धि होगी व हमारे कई तटीय नगर जल समाधि ले लेगें। पृथ्वी के तापमान में वृद्धि से सिर्फ समुद्र का जल स्तर ही नहीं बढ़ेगा, बल्कि और भी मौसम व जलवायु सम्बन्धी खतरनाक परिवर्तन हो सकते हैं, जैसे कहीं भयंकर तूफ़ान आना, कहीं सुखा पड़ना, तेज हवाएं चलना आदि।
वातानुकूलन
पृथ्वी पर किसी स्थान की जलवायु वहाँ के ताप, आपेक्षिक आर्द्रता, तथा वायु बहने की दिशा से निर्धारित होती है। सामान्यतः मनुष्य के स्वास्थ्य व अनुकूल जलवायु के लिये निम्न परिस्थितियां होनी चाहिए।
- ताप – 23°C से 25°C
- आपेक्षिक आर्द्रता – 60 प्रतिशत से 65 प्रतिशत
- वायु की गति 75 मी./मिनट से 2.5 मी./मिनट तक
यदि किसी स्थान की जलवायु उपर्युक्त परिस्थितियों के अनुसार नहीं होती तो वह जलवायु मनुष्य के लिए आरामदेह व स्वास्थ्यकर नहीं होती। अत: इसको अनुकूलन बनाने के लिये इन बाह्य परिस्थितियों को कृत्रिम रूप से निर्धारित व नियन्त्रित करने की प्रक्रिया को ही वातानुकूलन कहते हैं।
बोलोमीटर: लांगली ने विकिरण-ऊर्जा मापने के लिए सुग्राही यन्त्र की रचना की। ताप के साथ शुद्ध प्लेटिनम के प्रतिरोध के परिवर्तन के सिद्धांत का सहयोग इसमें किया जाता है। इस यन्त्र को बोलोमीटर कहते हैं।
सोलर कुकर
इस उपकरण में सौर ऊर्जा का संग्रहण करके उसका उपयोग खाना बनाने में किया जाता है। सूर्य के प्रकाश का लगभग 1/3 भाग अवरक्त प्रकाश होता है, जो उस वस्तु को गरम कर देता है, जिस पर वह आपतित होता है।
रचना: यह एक फाइबर ग्लास की बनी एक पेटिका होती है जिसके अन्दर का भाग काले रंग से रंग दिया जाता है, क्योंकि काला रंग ऊष्मा को लगभग पूर्णत: अवशोषित करता है। पेटिका का ऊपरी भाग मोटी कांच की प्लेटों द्वारा ढक दिया जाता है। पेटिका के ढक्कन पर अन्दर की तरफ एक समतल दर्पण लगा होता है, जो सूर्य के प्रकाश को उसके अन्दर परावर्तित करता है। पेटिका के अन्दर ऐलुमिनियम के बर्तन रखे जाते हैं जो बाहर से काले रंग से रंगे होते हैं। इन बर्तनों में सब्जियां आदि पकाने के लिए रखी जाती हैं। पेटिका के आकार के अनुसार उसमें दो या तीन छोटे-छोटे बर्तन रखे जा सकते हैं।
कार्यविधि: सौर कुकर को धूप में रखा जाता है तथा ढक्कन को इस प्रकार मोड़कर रखा जाता है कि सूर्य का प्रकाश समतल दर्पण से परावर्तित होकर सौर कुकर के अन्दर प्रवेश करे। पेटिका के अन्दर का काला रंग तथा बर्तनों के बाहर का काला रंग ऊष्मा को अवशोषित करता है। पेटिका के ऊपर रखी गई कांच की प्लेट ग्रीन हाउस उत्पन्न करती है, जिसके कारण पेटिका के अन्दर का ताप बढ़ता जाता है और खाने की वस्तुएं पक जाती हैं।
विशिष्ट ऊष्मा: पदार्थ की विशिष्ट ऊष्मा उसके एकांक द्रव्यमान के ताप को एक डिग्री से बढाने के लिये आवश्यक ऊष्मा का परिमाण है, विशिष्ट ऊष्मा को ऊष्मा धारिता भी कहते हैं। विशिष्ट ऊष्मा का SI मात्रक जूल प्रति किग्रा. प्रति डिग्री सेल्सियस होता है (J/Kg/°C)
ऊष्मा धारिता: पिण्ड को दी गई ऊष्मा का परिमाण तथा उस ऊष्मा के कारण उसके ताप में जो वृद्धि होती है, उसके अनुपात को उस पिण्ड की ऊष्मा धारिता कहते हैं।
एक कैलोरी परिमाण की ऊष्मा वह ऊष्मा है, जिससे 15°C पर के एक ग्राम पानी के ताप को 1°C से बढ़ाया जाता है। ऊष्मा का बड़ा मात्रक किलो कैलोरी है, जो 1000 कैलोरी के बराबर होता है।
अवस्था परिवर्तन
पदार्थ में ऊष्मा दिए जाने पर तीन प्रकार से प्रभाव पड़ता है –
- ऊष्मा दिए जाने पर पदार्थ ताप का बढ़ना और ऊष्मा निकाल दिए जाने पर वह आकार में सिकुड़ता है।
- ऊष्मा दिए जाने पर पदार्थ के ताप का बढ़ना और ऊष्मा निकाले जाने पर उसके ताप का घटना।
- ऊष्मा पाकर या खोकर पदार्थ की भौतिक अवस्था में परिवर्तन होना, अर्थात् ठोस का द्रव में और द्रव का वाष्प में बदल जाना या वाष्प का द्रव में और द्रव का ठोस में बदल जाना। इनका उदाहरण है बर्फ का जल और जल का भाप में बदलना या भाप का जल में और जल का बर्फ में बदलना।
अवस्था परिवर्तन की स्थिति में पदार्थ को दी गयी या ली गयी ऊष्मा से उसका ताप नहीं बदलता। ठोस अवस्था में पदार्थ के अणु आपसी आकर्षण से लैटिसों में जकड़े रहते हैं। ऐसी अवस्था में ठोस को जो ऊष्मीय ऊर्जा दी जाती है उसका अणुओं के आपसी आकर्षण के विरूद्ध कार्य करने में होता है, ताकि अणुओं के अलग होने से पदार्थ की अवस्था बदले। कार्य का यह सिलसिला तब तक चलता है, जब तक पूरा का पूरा ठोस धीरे-धीरे गलकर बदल नहीं जाता। द्रव की अवस्था से वाष्प की अवस्था में अपने में पदार्थ को दी गयी ऊष्मीय ऊर्जा का खर्च होता है।
अवस्था में परिवर्तन
गलनांक: जिस ताप पर पदार्थ ऊष्मा पाकर गलता है, अर्थात ठोस से द्रव में बदलता है। उसे पदार्थ का गलनांक कहते हैं।
क्वथनांक: जिस ताप पर पदार्थ ऊष्मा पाकर उबलता है, अर्थात् द्रव उबलकर वाष्प में बदलता है, उसे पदार्थ का क्वथनांक कहते हैं।
दाब के साथ पदार्थों के गलनांक या क्वथनांक में परिवर्तन
ठोस पदार्थों पर दाब डालने पर वे सिकुड़ते हैं जिससे उनका आयतन घटता है और उसके फलस्वरूप उनका घनत्व बढ़ता है अधिक घना होने पर उनके अणु एक दूसरे के अपेक्षाकृत अधिक निकट आ जाते हैं, जिससे उनके गलने का ताप बढ़ जाता है। इससे स्पष्ट है कि ऐसे ठोस पदार्थ जब गलेंगे तब उनका आयतन बढ़ेगा, अर्थात् घनत्व घटेगा।
कुछ ऐसे भी ठोस पदार्थ होते है जिनका आयतन गलने पर घटता है, अर्थात घनत्व बढता है इनके गलनांक दाब के बढ़ने से घटते है। बर्फ, ढलवां लोहा आदि ऐसे ही पदार्थ हैं, इन पर लगाए गए दाब ही गलते समय इनके आयतन को घटाने में सहायक होते हैं।
द्रव की अवस्था में उबलने की क्रिया से पदार्थ वाष्पित होता है वाष्पित होने पदार्थ का आयतन बढ़ता है लेकिन दाब की वृद्धि आयतन के बढ़ने में बाधक होता है जो आमतौर पर दाब की वृद्धि का समानुपाती होता है दाब के परिवर्तन से क्वथनांक में जो परिवर्तन होता है। वह द्रव की प्रकृति पर निर्भर करता है। समुद्र के तल से ऊंचाई बढ़ने पर वायुमण्डलीय दाब घटता है। अत: जल का क्वथनांक ऊंचाई बढ़ने से घटता है कि पहाड़ों पर जल 100°C से नीचे की ताप पर उबलता है और खाना पकाने के लिए प्रेशर-कुकर अधिक उपयोगी होती है।
गुप्त ऊष्मा: अवस्था परिवर्तन को समय स्थिर ताप पर पदार्थ के एकांक द्रव्यमान को दी गई आवश्यक ऊष्मा की मात्रा को गुप्त ऊष्मा कहते हैं। ठण्डे पेय पदार्थों की बोतलों को ठण्डा रखने के लिए उन्हें 0°C के पानी में रखकर बर्फ से ढंक देते है। ऐसा करने से पेय पदार्थ ज्यादा ठण्डे बने रहते हैं क्योंकि जब बर्फ 0°C के जल में परिवर्तित होती है तो 336 जूल ऊष्मा अवशोषित करती है। इसी प्रकार 100°C के जल की अपेक्षा 100°C के जल की 1 ग्राम भाग 100°C के जल में परिवर्तित होती है तो 2260 जूल या 540 कैलोरी अधिक ऊष्मा देती है।
[latex]Q=mL[/latex]
m = द्रव्यमान, L = गुप्त ऊष्मा (coefficient)
गलन की गुप्त ऊष्मा: ठोस पदार्थ के एकांक द्रव्यमान को उसके गलनांक पर द्रव में बदलने के लिए आवश्यक ऊष्मा को ठोस के गलन की गुप्त ऊष्मा कहते हैं इसका मात्रक जूल प्रति किग्रा होता है।
क्वथन की गुप्त ऊष्मा: द्रव पदार्थ के एकांक द्रव्यमान को इसके क्वथनांक पर वाष्प में बदलने के लिए आवश्यक ऊष्मा को द्रव के क्वथन की गुप्त ऊष्मा कहते हैं। इसका भी SI मात्रक जूल प्रति किग्रा ही होता है। वायुमण्डल के सामान्य दाब पर जल के क्वथन की गुप्त ऊष्मा 2.26 × 105J/Kg होती है।
रुद्धोष्म परिवर्तन: जब हवा ऊपर उठती है, तो इसमें फैलाव होने से इसके आयतन में वृद्धि होती है। इससे प्रति इकाई आयतन में उपलब्ध ऊष्मा घटती है और इसलिये तापमान में भी ह्रास होता है। इस प्रकार का ताप परिवर्तन जिसका संबंध हवा के फैलाव और ऊपर उठने से हैं रुद्धोष्म परिवर्तन कहलाता है। हवा का उर्ध्वाधर विस्थापन ही रुद्धोष्म तथा अवरोही ताप परिवर्तन मुख्य कारण है। हवा जब ऊपर उठती है तो उसका तापमान घटता है ऊपर उठने वाली हवा में तापमान की गिरावट की दर हवा में मौजूद नमी की मात्रा पर निर्भर करती है।
ओस: हवा का जलवाष्प जब संघनित होकर नन्हीं बूंदों के रूप में धरातल पर स्थित घास और पौधों की पत्तियों पर जमा हो जाता है तो इसे ओस कहते हैं।
तुषार (पाला): जब संघनन एक ऐसे ओसांक पर होता है जो हिमांक से नीचे हो, तो अतिरिक्त जलवाष्प जल कणों के बदले हिम कणों के रूप में जमा होता है, इसे तुषार पाला कहते हैं।
कुहरा: यह एक प्रकार का बादल है, जिसका आधार पृथ्वी के धरातल पर उसके बिल्कुल समीप होता है। ठण्डी होने की प्रक्रिया की प्रकृति के आधार पर कुहरा कई प्रकार का होता है यदि भौतिक विकिरण द्वारा धरातल तथा उसके समीप की हवा ठण्डी होती है तो उससे बने कुहरे को विकिरण कुहरा कहते हैं।
कुहासा (धुंध): कुहासा भी एक प्रकार का कुहरा है। इसमें कुहरा की अपेक्षा दृश्यता दूर तक रहती है। इसमें दृश्यता एक किलोमीटर से अधिक किंतु दो किलोमीटर से कम होती है।
हिमकर मिश्रण: हिमकर मिश्रण प्राप्त करने के लिए 0°C या उससे कम तापमान प्राप्त करने की आवश्यकता होती है। यह मिश्रण ऐसे दो द्रव्यों को मिलाकर बनाया जाता है, जिसमें से एक को ठोस से द्रव बनने में जितनी ऊष्मा की आवश्यकता होती है, उतनी ऊष्मा उसे मिश्रण से उपलब्ध होती है। फलत: मिश्रण का तापमान निम्न हो जाता है। बर्फ के टुकड़ों को साधारण नमक के साथ मिलाकर हिमकर मिश्रण बनाया जाता है, जिसका तापमान -21°C होता है।
ऊष्मागतिकी
भौतिकी की वह शाखा, जिसके अन्तर्गत ऊष्मीय ऊर्जा का यांत्रिक ऊर्जा, रसायनिक ऊर्जा, विद्युत ऊर्जा आदि के साथ सम्बन्ध हो, ऊष्मा गतिकी कहलाता है।
ऊष्मागतिकी का प्रथम नियम
ऊष्मागतिकी के प्रथम नियम के अनुसार, किसी निकाय को दी जाने वाली ऊष्मा दो प्रकार के कार्यों में व्यय होती है- (1) निकाय की आन्तरिक ऊर्जा में वृद्धि करने में जिससे निकाय का ताप बढ़ता है एवं (2) बाह्य कार्य करने में। यह नियम मुख्यत: ऊर्जा के संरक्षण को प्रदर्शित करता है। मान लिया कि किसी निकाय को ऊष्मा दी गयी है तो ऊष्मागतिकी के प्रथम नियम के अनुसार जहां:
Q = U+W
जहां U आन्तरिक ऊर्जा में वृद्धि है तथा W निकाय द्वारा किया गया बाह्य कार्य है।
ऊष्मागतिकी का दूसरा नियम
ऊष्मागतिकी का दूसरा नियम ऊष्मा के प्रवाहित होने की दिशा को व्यक्त करता है। इस नियम के अनुसार (1) ऊष्मा का पूर्णतया कार्य में परिवर्तन असम्भव है एवं (2) ऊष्मा अपने कम ताप की वस्तु से अधिक ताप की वस्तु की ओर प्रवाहित नहीं हो सकती, जब तक कि बाह्य ऊर्जा का उपयोग न किया जाए।
न्यूटन का शीतलन नियम
इस नियम के अनुसार किसी वस्तु के ठण्डे होने की दर वस्तु तथा उसके चारों ओर के माध्यम के तापान्तर के अनुक्रमानुपाती होती है। अत: वस्तु जैसे-जैसे ठण्डी होती जाएगी उसके ठण्डे होने की दर कम होती जाएगी। उदाहरणस्वरूप, गर्म पानी का 90°C से 80°C तक ठण्डा होने में लिया गया समय 40°C से 30°C तक ठण्डा होने में लिए गए समय की अपेक्षा कम होता है।
ऊष्मा इंजन
ऊष्मा इंजन ऐसी युक्ति है, जो ऊष्मा को यांत्रिक ऊर्जा में बदलता है। ऊष्मा इंजन दो प्रकार के होते हैं- बहिर्दहन इंजन और आंतरिक दहन इंजन।
- बर्हिदहन इंजन: वैसे ऊष्मा इंजन जो मशीनों और रेलगाड़ियों को वाष्प शक्ति की मदद से चलाते हैं, बर्हिदहन इंजन कहलाते हैं। ऐसे इंजन में जल को इंजन के बाहर कोयले को जलाकर एक बॉयलर में उबाला जाता है और निश्चित ताप पर जल का जो भाप बनता है, उसे बाहर से इंजन की भीतर भेजा जाता है। बर्हिदहन इंजन का कार्यकारी पदार्थ जल का भाप होता है। यही कारण है कि ऐसे इंजन को भाप इंजन भी कहते हैं।
- आंतरिक दहन इंजन: वैसे ऊष्मा इंजन, जिसमें कार्यकारी पदार्थ हवा होती है एवं इंजन के भीतर ही ईधन को जलाकर कार्यकारी पदार्थ के ताप को बढ़ाया जाता है, आतरिक दहन इंजन कहलाता है। ऐसे इंजन में हवा और पेट्रोल या डीजल को वाष्प का मिश्रण इंजन के भीतर ही जलाकर शक्ति उत्पन्न करते हैं और तरह-तरह की मशीनों, मोटरगाड़ियों, ट्रकों, रेलगाड़ियों, स्कूटर, मोपेडों और मोटरसाइकिलों को चलाते हैं। ईधन के रूप में पेट्रोल का उपयोग करने वाले इंजन को पेट्रोल इंजन और डीजल का उपयोग करने वाले इंजन को डीजल इंजन कहते हैं।
इंजन की दक्षता: दी गयी ऊष्मा का जो प्रतिशत इंजन द्वारा कार्य में बदला जाता है, उसे इंजन की दक्षता कहते हैं। भाप इंजन दी गयी ऊष्मा का मात्र 8 से 10 प्रतिशत ही यांत्रिक ऊर्जा में बदल पाता है और इससे ऊष्मा की काफी हानि होती है। परन्तु आंतरिक दहन इंजन इससे कहीं ज्यादा ऊष्मा को कार्य में बदलता है। दी गयी ऊष्मा का लगभग 25 प्रतिशत पेट्रोल इंजन की और 35 प्रतिशत डीजल इंजन की उपयोगी ऊर्जा होती है।
बर्हिदहन इंजन-भाप इंजन: भाप इंजन में ऊष्मीय ऊर्जा को यांत्रिक ऊर्जा में रुपांतरित किया जाता है। टॉमस न्यूकामेन ने 1705 ई. में प्रथम सफल इंजन का निर्माण किया, जो खानों से पानी निकालने में प्रयुक्त किया जाता था। इस इंजन की दक्षता केवल 1 प्रतिशत थी। बाद में जेम्स वाट ने ऐसे भाप इंजन की रचना की जिसके मौलिक तत्व आधुनिक भाप इंजन में भी प्रयुक्त होते हैं। आजकल के भाप इंजनों की दक्षता 10 प्रतिशत तक होती है।
भाप इंजन का उपयोग कारखानों में विभिन्न प्रकार की मशीनों, रेलगाड़ी तथा जहाजों आदि को चलाने में किया जाता है, परंतु इसका उपयोग मोटरगाड़ी, स्कूटर, मोटर साईकिल इत्यादि में नहीं किया जा सकता, क्योंकि यह इंजन बहुत अधिक जगह घेरता है।
आंतरिक दहन इंजन-डीजल इंजन: जिस आतंरिक दहन इंजन में हवा कार्यकारी पदार्थ होती है और डीजल का वाष्प ईंधन होता है, उसे डीजल ईंधन कहते हैं। इस इंजन का कार्यकारी पदार्थ नियम दाब पर ऊष्मा लेता है। पेट्रोल की तुलना में डीजल कच्चा होने के कारण अधिक सस्ता होता है। अत: डीजल का उपयोग करने वाली गाड़ियों को चलाने में कम खर्च पड़ता है लेकिन, ऐसे इंजन अपेक्षाकृत अधिक महगे होते हैं क्योंकि उनके निर्माण का खर्च अधिक होता है।
आन्तरिक दहन इंजन: पेट्रोल इंजन-जिस आंतरिक दहन इंजन में हवा कार्यकारी पदार्थ होती है और पेट्रोल का वाष्प ईधन होता है, इसे पेट्रोल इंजन कहते हैं। पेट्रोल का कार्यकारी पदार्थ नियत आयतन पर ऊष्मा लेता है इस इंजन में एक कार्डरेटर लगा होता है, जिसमें स्कोर छेद से होकर पेट्रोल के फुहारे छोड़े जाते हैं। यहीं पर पेट्रोल के फुहारे के कणों को हवा से मिलने पर इंजन के कक्ष में विस्फोटक मिश्रण तैयार होता है। यह मिश्रण इस कक्ष में लगे प्रवेश वाल्व से होकर इंजन की एक खाली कक्ष में पहुंचता है, जिसे ज्वलन-प्रकोष्ठ कहते हैं, ज्वलन प्रकोष्ठ में विद्युत-विसर्जन से चिनगारियां पैदा करने वाले स्पार्क-प्लग लगे होते हैं। इससे पेट्रोल के कण जलते हैं। जिस कारण हवा का ताप बहुत बढ़ जाता है। इंजन का खोखला बेलन ज्वलन प्रकोष्ठ का ही एक बढ़ा हुआ भाग होता है, जिसमें बेलनाकार पिस्टन लगा होता है। यह बेलन एक झडे के एक छोर से जुड़ा होता है और झंडे का दूसरा छोर चक्के की सैंक धुरी से जुड़ा रहता है जो चक्क को उसके अक्ष पर नचाता है। ऐसे ही चक्के गाड़ी इंजन में एक और वाल्व होता है। जिसकी ओर पेट्रोल की नली होती है और जिसे खोलकर निकास पाइप से वायुमण्डल में चली जाती है।