अणु, परमाणु एवं परमाणु संरचना Molecule, Atom and Atomic Structure
अणु Molecule
अणु किसी पदार्थ का वह छोटा-से-छोटा भाग हैं, जिसमें पदार्थ के सभी गुण विद्यमान होते हैं। यह मुक्त अवस्था में रह सकता है। ये दो प्रकार के होते हैं-
- समपरमाणुक (Homato Atomic): ये अणु तत्वों से मिलकर बने होते हैं, जैसे-H2
किसी अणु में उपस्थित कुल परमाणुओं की संख्या को परमाणुकता कहते हैं।
- विषमपरमाणुक (Hetero Atomic): ये अणु विभिन्न प्रकार के परमाणुओं से मिलकर बने होते हैं, जैसे-HCl, CO2, H2SO4 आदि।
परमाणु Atom
परमाणु किसी तत्व का वह सूक्ष्म भाग है, जो किसी भी रासायनिक परिवर्तन में भाग ले सकता है, परन्तु मुक्तावस्था में नहीं रह सकता। सभी तत्वों के परमाणु अत्यधिक क्रियाशील होते हैं, लेकिन ये मुक्त अवस्था में न रहकर, अपने ही यौगिक के किसी दूसरे या समान तत्व के साथ संयुक्त अवस्था में रहते हैं। केवल आदर्श गैसों के परमाणु ही अक्रियाशील होते हैं और मुक्त अवस्था में रह सकते हैं।
डाल्टन का परमाणुवाद
भारतीय ऋषि कणाद (800 ई.) ने सर्वप्रथम परमाणु सिद्धान्त दिया, जिसे यूनानी दार्शनिकों लूसियस तथा डिमोक्राइटिस ने आगे बढ़ाया और 1808 ई. में जान डाल्टन ने प्रयोगों द्वारा इसकी पुष्टि की।
डाल्टन का परमाणुवाद निम्नवत् है–
- प्रत्येक पदार्थ अत्यंत सूक्ष्म कणों से मिलकर बना होता है जिन्हें परमाणु कहते हैं। परमाणु अविभाज्य होता है।
- परमाणु न तो उत्पन्न किया जा सकता है और न ही नष्ट।
- एक ही तत्व के सभी परमाणु आकार, द्रव्यमान तथा रासायनिक गुणों में समान होते हैं, किंतु दूसरे तत्व के परमाणु से भिन्न होते हैं।
- रासायनिक परिवर्तनों में परमाणु अपनी निजी सत्ता बनाये रखते हैं।
- किसी भी यौगिक के समस्त यौगिक परमाणु (अणु) आपस में समान होते हैं और तत्व का संयोजन भार ही परमाणुओं का संयोजन भार होता है।
डाल्टन ने परमाणुवाद की कमियों को दूर कर आधुनिक परमाणुवाद का सिद्धान्त दिया। यह परमाणु की विभाज्यता, समस्थानिकता तथा समभारिता आदि को व्याख्यित कर सका।
परमाणु की संरचना Structure of Atom
20 वीं सदी के पूर्व तक माना जाता था कि परमाणु अविभाज्य हैं परन्तु जे.जे. थॉमसन, रदरफोर्ड, चैडविक आदि ने सिद्ध कर दिया कि परमाणु को विभाजित किया जा सकता है। परमाणु में इलेक्ट्रान, प्रोट्रान एवं न्यूट्रान स्थाई तथा पाजिट्रान, न्यूट्रिनों, एन्टिन्यूट्रिनों तथा मेसान आदि अस्थाई कण होते हैं।
इलेक्ट्रान Electron: इलेक्ट्रान की खोज जे.जे. थॉमसन ने की थी। इसकी इकाई ऋणावेश होती है। इसका विराम द्रव्यमान 9.1 × 10-19 कूलॉम आवेश होता है। ये परमाणु के नाभिक के चारों ओर अपनी निश्चित कक्षाओं में चक्कर काटते हैं।
प्रोट्रॉन Protron: इसकी खोज रदरफोर्ड ने की थी। इस पर इलेक्ट्रान के आवेश के बराबर धनावेश होता है। इसका आवेश 1.6 × 10-19 कूलॉम होता है। यह परमाणु के नाभिक में न्यूट्रान के साथ पाया जाता है।
न्यूट्रॉन Neutron: इसकी खोज चैडविक ने की थी। वह विद्युत उदासीन कण है। इसका भार प्रोटॉन के भार (1.6748 × 10-24) के बराबर होता है। प्रोट्रॉन के साथ नाभिक में न्यूट्रान स्थायी होता है परन्तु नाभिक के बाहर स्वतंत्र अवस्था में अस्थायी होता है।
परमाणु मॉडल Atomic Model
थॉमसन का मॉडल: 1903 ई. में सर्वप्रथम थामसन ने परमाणु मॉडल प्रस्तुत किया, जिसके अनुसार परमाणु ठोस गोलाकार आकृति के समान है, जिसमें धनावेशित तथा ऋणावेशित कण समान रुप से वितरित रहते हैं। परमाणु का द्रव्यमान, परमाणु के चारों ओर असमान रुप से फैला रहता है। थामसन के परमाणु मॉडल ने परमाणु की विद्युत उदासीनता को तो स्पष्ट कर दिया। परन्तु अल्फा कण (±) रदरफोर्ड को प्रयोग को स्पष्ट नहीं कर सका।
रदरफोर्ड का मॉडल: रदरफोर्ड ने 1911ई. अल्फा कणों (±) के प्रकीर्णन प्रयोग से प्राप्त निष्कर्षों से परमाणु मॉडल प्रस्तुत किया। इसके अनुसार-
- परमाणु अतिसूक्ष्म, गोलाकार, विद्युत उदासीन कण हैं, जो धनावेशित नाभिक और इसके बाहरी भाग, जिसमें इलेक्ट्रान रहते हैं, से बना है।
- परमाणु का कुल धनावेश और लगभग समस्त द्रव्यमान केन्द्र में संचित रहता है, जिसे नाभिक कहते हैं।
- परमाणु में इलेक्ट्रान नाभिक के चारों ओर घूमते रहते हैं।
- परमाणु में इलेक्ट्रानों की संख्या, परमाणु नाभिक पर स्थित धनावेशों की संख्या के बराबर होती है, इसीलिए परमाणु उदासीन होते हैं।
- इलेक्ट्रानों पर नाभिक आकर्षण बल आरोपित करता है। इलेक्ट्रानों के परिक्रमण से उत्पन्न अपकेन्द्र बल, नाभिक के आकर्षण बल को सन्तुलित करता है। इससे इलेक्ट्रान, नाभिक में नहीं गिरता है।
नील्स बोर ने 1913 ई. में रदरफोर्ड के दोषों को दूर कर नया मॉडल क्वांटम सिद्धान्त मॉडल दिया।
नील्स बोर का मॉडल
नील्स बोर के मॉडल के बारे में हाइड्रोजन स्पेक्ट्रम की व्याख्या कर क्वांटम मैकेनिकल मॉडल प्रस्तुत किया गया, जिसके अनुसार-
- परमाणु के केन्द्र में एक नाभिक होता है, जहां प्रोट्रॉन तथा न्यूट्रान स्थित होते हैं। नाभिक का आकार बहुत छोटा होता है।
- इलेक्ट्रान नाभिक के चारों ओर एक निश्चित गोलाकार पथ में चक्कर लगाते रहते हैं, जिन्हें ऊर्जा स्तर कहते हैं। नाभिक व इलेक्ट्रान के बीच में एक आकर्षण बल कार्य करता है, जो इलेक्ट्रान के अभिकेन्द्रीय बल के बराबर होता है।
- प्रत्येक ऊर्जा स्तर की एक निष्चित ऊर्जा होती है।
- ऊर्जा स्तरों को क्रमश: K, L, M, N (1. 2. 3.4) कहते हैं।
- जब एक इलेक्ट्रान उच्च ऊर्जा स्तर से निम्न ऊर्जा स्तर में आता है या निम्न ऊर्जा स्तर से उच्च ऊर्जा स्तर में जाता है, तो इसमें ऊर्जा परिवर्तन होता है। निम्न कक्षा से उच्च में जाने पर ऊर्जा का अवशोषण, तथा उच्च से निम्न में जाने पर ऊर्जा का उत्सर्जन होता है।
- इलेक्ट्रान नाभिक के चारों ओर केवल उन्हीं कक्षाओं में घूम सकता है, जिनमें उसका कोणीय संवेग (m v r) n/2A का सरल गुणांक होता है। अर्थात्
[latex]mvr=n\frac { h }{ 2\pi }[/latex]
जहां n मुख्य क्वांटम संख्या = 1, 2, 3 या 4
v इलेक्ट्रान का वेग,
r कक्षा की त्रिज्या
m इलेक्ट्रान का द्रव्यमान,
n प्लांक नियतांक
इलेक्ट्रनिक विन्यास
परमाणु में इलेक्ट्रान नाभिक के चारों ओर विभिन्न कक्षाओं में घूमते रहते हैं। नील्स बोर तथा बरी ने परमाणु की विभिन्न कक्षाओं में इलेक्ट्रानों की संख्या ज्ञात करने के कुछ नियम बनाये, जिसे बोर-बरी योजना कहते हैं। इसके अनुसार-
- किसी कक्षा में इलेक्ट्रानों की अधिकतम संख्या 20 होती है। जहां n कक्षा की संख्या है।
- परमाणु की सबसे बाहरी कक्षा में 8 से अधिक तथा इससे पहली वाली कक्षा में 18 से अधिक इलेक्ट्रान नहीं हो सकते हैं।
- आवश्यक नहीं है कि किसी कक्षा में इलेक्ट्रानों की संख्या 2n2 के अनुसार पूर्ण होने पर ही इलेक्ट्रान उससे अगली कक्षा में जायेंगे, अपितु जब बाह्य कक्षा में 8 इलेक्ट्रान हो जाते हैं तो इलेक्ट्रान नयी कक्षा में प्रवेश करना प्रारम्भ कर देते हैं।
- सबसे बाहरी कक्षा में 2 से अधिक तथा उससे पहले वाली कक्षा में 9 से अधिक इलेक्ट्रॉन तब तक नहीं हो सकते, जब तक कि बाहर से तीसरी कक्षा में इलेक्ट्रान की संख्या 2n2 के अनुसार पूरी न हो जाये।
इस नियम से किसी तत्व का परमाणु क्रमांक तथा परमाणु भार ज्ञात होने पर, उस तत्व की परमाणु संरचना ज्ञात की जा सकती है। इस नियम के कुछ तत्वों पर अपवाद हैं, जैसे- कॉपर, सिल्वर, सोना, क्रोमियम आदि।
- कोष SheII: इलेक्ट्रान नाभिक के चारों ओर निश्चित कक्षाओं में चक्वर लगाते रहते हैं। इलेक्ट्रान तब तक इन कक्षाओं में चक्कर लगाते रहते हैं, जब तक वे ऊर्जा का उत्सर्जन या अवशोषण नहीं करते हैं। इन कक्षाओं को मुख्य उर्जा स्तर (Major Energy Level) या कोश कहते हैं। इन कक्षाओं को K L MN 1, 2, 3, 4 से प्रदर्शित किया जाता है। प्रत्येक कोष में अधिकतम इलेक्ट्रानों की 2n2 संख्या होती है। जहां n कोश संख्या है। आधुनिक परमाणु मॉडल के आधार पर इन्हें मुख्य क्वांटम संख्या कहते हैं।
- उपकोष (Sub Shell): प्रत्येक कोश या मुख्य ऊर्जा स्तर की ऊर्जाएं समान नहीं होती हैं। कोषों को पुन: छोटे-छोटे कोषों में विभाजित किया गया है, जिन्हें उपकोष कहते हैं। इन्हें क्रमश: s, p, d, f अक्षरों से प्रदर्शित करते हैं। प्रथम कोष को एक, द्वितीय को दो, तृतीय को तीन तथा चतुर्थ को चार उपकोषों में विभाजित किया गया है।
- कक्षक (Orbital): किसी परमाणु के नाभिक के चारों ओर का वह त्रिविमीय क्षेत्र, जहां इलेक्ट्रान पाये जाने की सम्भावना अधिकतम होती है, कक्षक कहलाता है।
नाभिक के चारों ओर इलेक्ट्रान तीव्र गति से परिक्रमा करते हैं। इस कारण नाभिक के आस-पास ऋणात्मक विद्युत आवेश का एक धुंधला बादल-सा बन जाता है, जिसे इलेक्ट्रान मेघ (Electron Cloud) कहते हैं। इलेक्ट्रान मेघ में ही इलेक्ट्रान के पाये जाने की प्रायिकता अधिक होती है।
ऑफबाऊ नियम Aufbou Principle
ऑफबाऊ जर्मन भाषा का शब्द है, जिसका अभिप्राय बनाना या रचना करना है। तत्वों के इलेक्ट्रानिक विन्यास बनाने का नियम ऑफबाऊ नियम कहलाता है। इस नियम के अनुसार, किसी भी परमाणु में उपस्थित विभिन्न कक्षकों में इलेक्ट्रान ऊर्जा के बढ़ते क्रम में प्रवेश करता है। इलेक्ट्रान सर्वप्रथम 1s कक्षक में प्रवेश करते हैं और जब 1s कक्षक पूर्ण हो जाता है तो इलेक्ट्रान 2s कक्षक में प्रवेश करते हैं। जब 2s कक्षक भी पूर्ण हो जाता है तो इलेक्ट्रान 2p कक्षक में प्रवेश करते हैं। इस प्रकार इलेक्ट्रान ऊर्जा के बढ़ते हुए क्रम में रिक्त कक्षकों में प्रवेश करते हैं। ऊर्जा का बढ़ता क्रम निम्न प्रकार है-
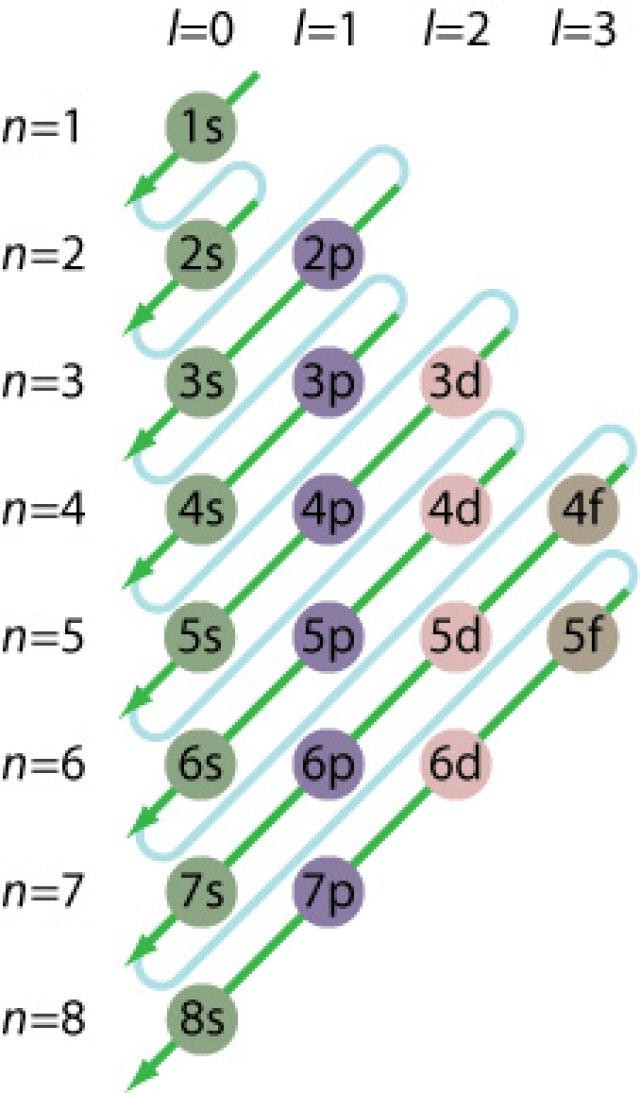
पाउली का अपवर्जन नियम
इसके अनुसार किसी परमाणु के किसी भी दो इलेक्ट्रानों के लिए चारों क्वांटम संख्याओं का मान एक समान नहीं हो सकता। यदि किसी पर बाकी तीनों क्वांटम संख्याओं का मान समान हो भी जाय, फिर भी स्पिन क्वांटम संख्या का मान (+1/2 व –1/2) समान नहीं हो सकता।
हुण्ड का नियम
इसके अनुसार, किसी भी कक्षा में इलेक्ट्रान इस प्रकार भरते हैं कि अधिक हों अर्थात् किसी भी कक्षा के उपकोषों में इलेक्ट्रान सर्वप्रथम एक-एक करके जाते हैं तथा बाद में युग्म बनाते हैं। वे परमाणु, जिनमें इलेक्ट्रान अयुग्मित रहते हैं, वे पराचुम्बकीय तथा वे परमाणु, जिनमें इलेक्ट्रान युग्मित रहते हैं, अनुचुम्बकीय कहलाते हैं।
किसी धातु की सतह को प्रकाश के समक्ष रखने पर होने वाला इलेक्ट्रानों का उत्सर्जन प्रकाश विद्युत प्रभाव कहलाता है। उत्सर्जित इलेक्ट्रानों को फोटो इलेक्ट्रान कहते हैं। वह न्यूनतम विभव, जिस पर फोटो विद्युत धारा शून्य हो जाती है, प्रतिरोधक विभव कहलाता है।



